
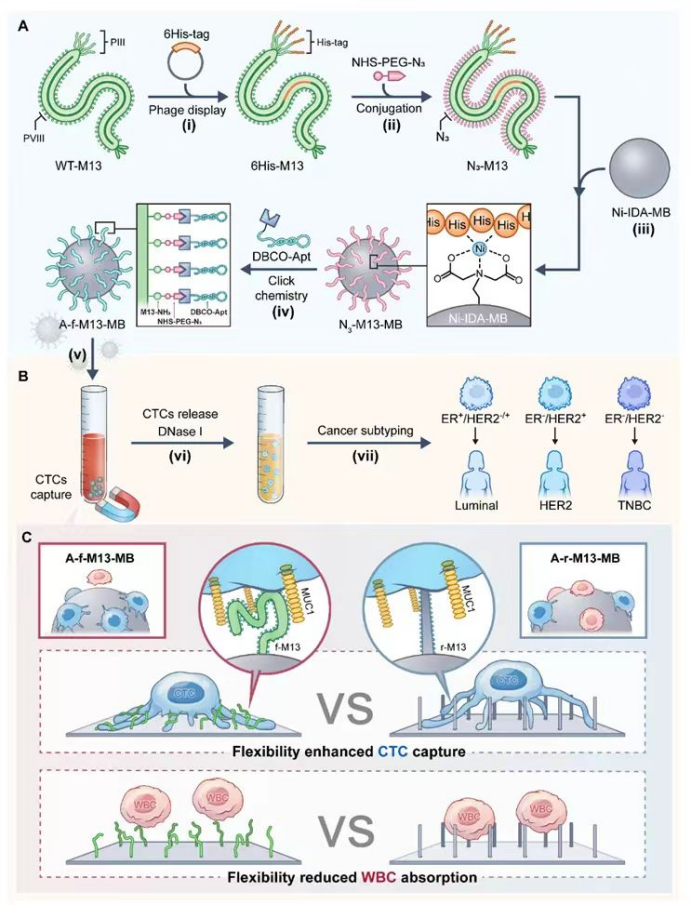
7月12日,由香港中文大学毛传斌教授团队,东北大学杨婷教授团队,辽宁省肿瘤医院李建一教授团队和苏州大学丁泓铭教授四方合作的重磅文章在Nature Communications上发表,题目为“Harnessing virus flexibility to selectively capture and profile rare circulating target cells for precise cancer subtyping”。
包括乳腺癌在内的上皮来源实体恶性肿瘤所释放入血的循环肿瘤细胞一直存在检出率、特异性及细胞分型等临床问题。该论文的最大新意在于,利用工程化丝状噬菌体的柔韧性(flexibility)和特异亲和性(target-specific binding affinity)从外周血中高效俘获和分离循环肿瘤细胞(CTC), 然后对分离的CTC进一步分析,确定肿瘤亚型。丝状噬菌体的背部修饰有识别CTC的核酸适配体,用于俘获CTC,同时噬菌体的端部展示有6xHis tag, 用于固定在磁珠上实现CTC分离。实现了高检出率、高特异性和肿瘤细胞再分型的完美结合。

构建有效抗污的生物表界面在临床诊断、环境监测和药物筛选等应用中具有重要意义。目前,研究者通常使用聚合物分子修饰的方式来提高界面抗污能力。然而,该策略存在聚合物分子与亲和配体竞争有限界面空间的问题,从而导致抗污能力或亲和力无法进一步提高。本工作利用基因工程和化学手段改造丝状噬菌体,通过噬菌体纤维的柔韧性和特异亲和性,构建了一种兼具高亲和性和强抗污能力的亲和界面,并通过其对CTC的捕获性能证明了这一策略的可行性。CTC是从原发病灶脱落并进入外周血液循环的肿瘤细胞,CTC的检测对于肿瘤预后评估具有重要意义,而其稀有性和异质性给CTC分析带来巨大挑战。
本研究将背部修饰有靶向MUC1适配体的M13噬菌体定向锚定于磁珠(通过噬菌体端部展示的6xHis tag和磁珠表面镍离子的螯合),构建可形变亲和界面A-f-M13-MB,并用于乳腺癌CTC捕获及分析。固定在磁珠表面的噬菌体通过自由扭曲来调整其表面修饰适配体的分布,可以使适配体最大限度地与CTC上的MUC1结合,增强了M13噬菌体和CTC之间的多价相互作用,从而实现了高效的CTC捕获。同时,由于M13噬菌体柔性导致的构象熵损失,可有效减少白细胞(WBC)的非特异吸附。
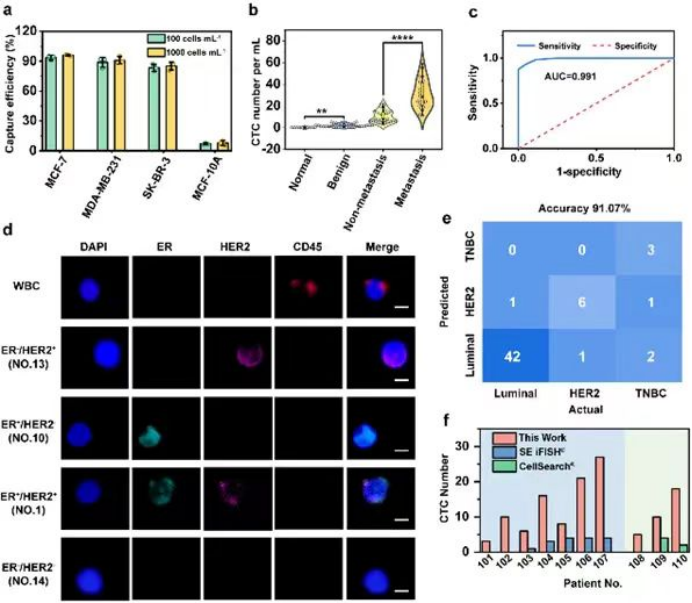
将该亲和界面应用于患者血液中CTC的高效捕获及表型分析,通过分析56名乳腺癌患者、34名良性患者和10名健康志愿者的血样来评估A-f-M13-MB的诊断效率,结果表明A-f-M13-MB成功地从所有乳腺癌患者中鉴定和分离出CTC。本方法诊断乳腺癌的阈值为>4个CTC/mL外周血,相较于CellSearch®阈值≥2个CTC/7.5 mL外周血,诊断灵敏度明显提升。此外,通过进一步对所捕获CTC进行免疫表型分析(ER和HER2)来确定乳腺癌亚型(Luminal, HER2, TNBC),其诊断准确率达到91.07%。将本研究方法同CellSearch®和SE iFISH®方法进行比较,表明具有较低的误检率和假阴性。本研究不仅为高性能界面的构建提供了新范式,也从生物力学层面为界面-细胞相互作用提供了新见解。
文章的第一作者是东北大学杨婷教授团队的博士生李慧达,共同通讯作者包括东北大学的杨婷教授、香港中文大学的毛传斌教授、辽宁省肿瘤医院的李建一教授、苏州大学丁泓铭教授。辽宁省肿瘤医院乳腺外科王聪医生及硕士研究生李竞岳具体负责患者标本的收集及患者资料统计分析。该项目得到了国家自然科学基金委、辽宁省兴辽英才计划、香港研究资助局的支持。







